1960年代に、致命的な先天異常を引き起こしたサリドマイドは現在、多発性骨髄腫やその他の血液癌の治療に広く使用されています。
また、その化学的親和性はC2H2 zinc finger(ZF)モチーフと呼ばれる特定の分子パターンを特徴付けられています。
転写因子と呼ばれる従来の「不可逆的」タンパク質である2つのタンパク質が細胞を破壊する働きをもってます。
Science誌”Thalidomide-targeted degradation”に、MIT and Harvardの Broad研究所、Dana-Farber 癌研究所、Brigham and Women’s 病院、Basel大学の研究者らは、サリドマイドと関連する薬が新しいクラスを確立するための出発点を提供できると言っています。同一のモチーフを有する推定800個の転写因子のうち多くを標的とするものです。
転写因子はDNAに結合し、しばしば特定の細胞型または組織に特異的なパターンで、多数の遺伝子の発現させます。
これらのタンパク質の誤転写は多くの癌に関連してますが、薬物開発の目的する場合、困難な問題であることを発見しました。
これは、転写因子が薬物分子が直接結合するためです。
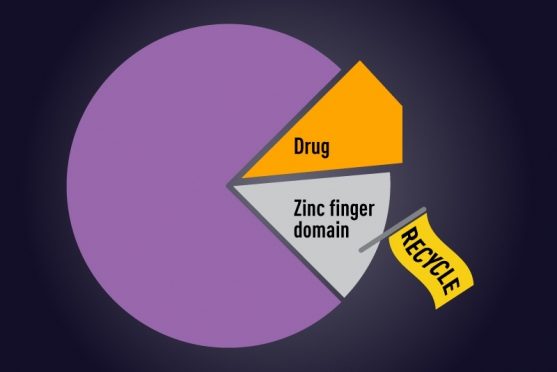
サリドマイドとその化学薬品のpomalidomideとlenalidomideはCereblonと呼ばれるタンパク質を徴集することによって間接的に標的(2つのC2H2 ZF含有転写因子IKZF1とIKZF3)を攻撃します。
CereblonはE3 ubiquitin ligaseと呼ばれる分子マシンの一部で、細胞リサイクルシステムの破壊タンパク質にフラグしてます。
サリドマイドとその従兄弟が存在しない場合、CereblonはIKZF1とIKZF3を無視します。しかし存在する場合、Cereblonはこれらの転写因子を認識し、処分のためにマークすることができます。
「サリドマイドのメカニズムの発見は、多くの点で驚くべきものでしたが、2 zinc finger 転写因子の分解をトリガーにする方法を私たちは持っていません」とBenjamin Ebertは言っています。(癌プログラムとDFCIの医学腫瘍学の議長)
古い薬の新しい役割の探索
ヒトゲノムは、IKZF1およびIKZF3と同様に、C2H2 ZF モチーフのいくつかの変異を有する推定800個の転写因子をコード化してます。薬物開発のための追加の要素を開く機会を認識し、EbertとQuinlan Sievers of Broad、DFCI、BWHが率いるチームは、バーゼル大学のGeorg PetzoldとNicolas Thomaは、他の同様の転写因子がサリドマイド様薬物も脆弱性を発見しました。
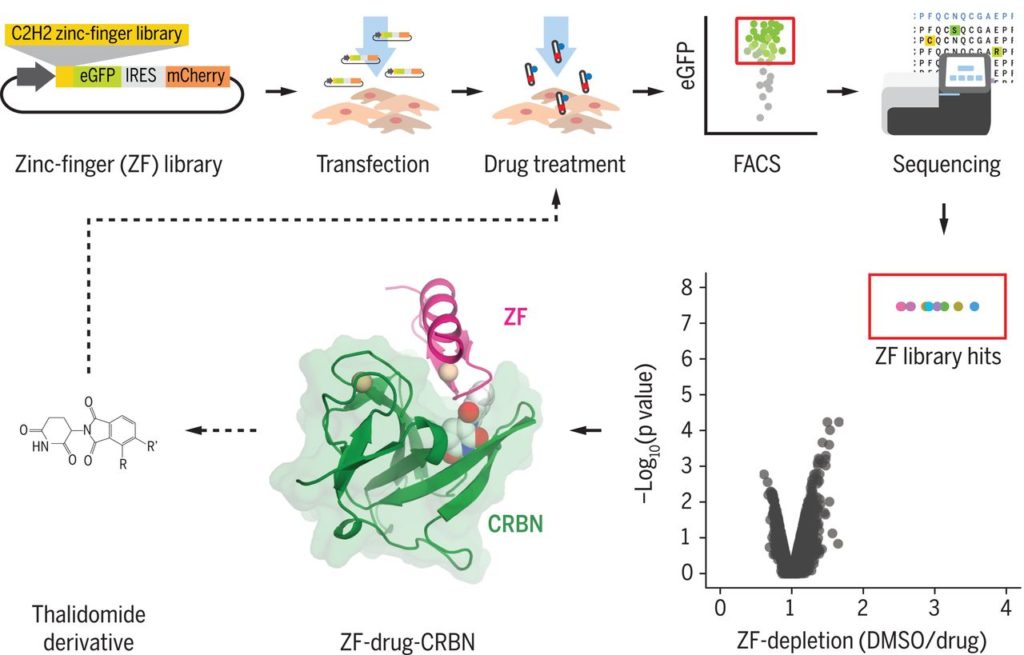
チームは、サリドマイド様の薬物が存在するときにcereblonを「見る」正確なC2H2のZF機能を決定することから始めました。彼らは、細胞モデルにおける6,572個のユニークなC2H2 ZF モチーフ変異の分解を引き起こす能力について、サリドマイドほか、pomalidomide, and lenalidomideをスクリーニングしました。スクリーニングで、薬物に脆弱な6種類のC2H2 ZF含有タンパク質が明らかになりました。そのうち4つは、以前にサリドマイドまたはその親類の標的として同定されていなかったものでした。
IKZF1とIKZF3のさらなる機能的および構造的研究を行って、転写因子、cereblonおよびサリドマイド薬がどのように相互作用するかを理解した後、チームは4,661のバリエーションのコンピュータモデルを実行して、cereblonをドッキングする可能性のある薬物の存在を確かめました。
計算データは、後続の生化学的研究とともに、適切に改変されたサリドマイド様薬物がcereblonをリサイクルのためのC2H2 ZF転写因子の特定のサブセットにフラグを立てるように「トリックする」ことができるはずです。
Ebert氏は、「これらの相互作用が特異的で非常に優れている」と述べています。「この薬物は細胞に特異的なzinc finger転写因子を分解させ、他のZinc Fingerタンパク質のみを残します。
新しい答え、新しい質問
調査結果はさらに多くの疑問を提起していると答えています。
例えば、本研究で強調されているC2H2 ZF転写因子の多くを知っています:どの細胞型が活性であり、どの遺伝子に影響を及ぼし、どの癌がそれに依存するのか。この知識は、研究者が標的とする可能性のある因子を優先順位付けし、それらを標的とする新しいサリドマイド誘導体を創製する段階を確立するのに役立つだろうと。
Ebert氏は、「しかしテイクホームのメッセージは、我々が当初思っていたよりも薬物誘発性の分解に敏感なジンクフィンガー転写因子の配列がはるかに多い」と語っています。
この作業の支援は、国立がん研究所、国立心臓、肺および血液検査、白血病およびリンパ腫学会、および他の情報源からです。Benjamin Ebertは、Howard Hughes Medical Instituteの研究者です。彼はCelgene(サリドマイド、レナリドマイド、およびPomalidomideを販売しています)から資金を受けていましたが、この研究では受けていません。
引用文献:
Sievers QL, Petzold G, et al. Defining the human C2H2 zinc finger degrome targeted by thalidomide analogs through CRBN. Science. Online November 1, 2018. DOI: 10.1126/science.aat0572.